Pfizerjevo zdravilo obeta veliko
Zdravilo menda za 90 odstotkov zmanjša hospitalizacije pri Covidu-19…

Podjetje Merck je pred slabim mesecem objavilo, da njihovo zdravilo Molnupiravir za polovico zmanjša tveganje za težak potek bolezni in smrt. Zdravilo je omenjeno farmacevtsko podjetje razvijalo že pred pandemijo, namenjeno pa je bilo zdravljenju virusne gripe, a ker so študije pokazale, da je učinkovito tudi proti SARS in MERS, so ga hitro prilagodili tudi za zdravljenje Covida-19.
Drugi pomemben »igralec« na tem področju je Pfizer. Njihov pristop je bil nekoliko drugačen od Merckovega. Podjetje že 20 let razvija zdravilo za SARS in najbolj obetavna je bila molekula z oznako PF-07321332. Pfizer jo je v začetku leta 2020 malce »sfriziral« tako, da je postala bolj učinkovita proti SARS-CoV-2 in jo preimenoval v PAXLOVID. Prvi rezultati so bili zelo obetajoči, zato je bila za zdravilo odobrena klinična faza testiranja in zdaj so znani prvi rezultati. In ti so zelo obetajoči.
Klinični testi so bili osredotočeni na okužene necepljene paciente z visokim tveganjem za težji potek bolezni. Prva »veja« kliničnega testiranja je zajemala 774 pacientov. 389 jih je pet dni prejemalo tablete Paxlovida, 385 pa placebo, pri obojih pa se je terapija pričela tretji dan od pojava simptomov. V skupini, ki je dobivala Paxlovid so le trije pacienti potrebovali bolnišnično oskrbo, umrl pa ni nihče, v skupini s placebom pa je bilo hospitaliziranih 27 bolnikov, 7 pa jih je umrlo.
V drugem, vzporednem testu, je bilo zajetih 1219 bolnikov, ki so terapijo pričeli dobivati peti dan po pojavu simptomov. Slaba polovica (607) jih je prejemala Paxlovid, ostali pa placebo. V prvi skupini je hospitalizacijo potrebovalo 6 ljudi, kar je slab odstotek, umrl pa ni nihče, v drugi pa je moralo v bolnišnico 41 bolnikov (6,7 odstotka), 10 pa jih je umrlo.
Rezultati so tako ohrabrujoči, da je neodvisna nadzorna komisija, ki je spremljala klinične teste odločila, da tretje faze, v kateri naj bi testirali več kot 3000 ljudi, ni potrebna in da lahko Ameriška Uprava za hrano in zdravila (FDA) že v naslednjih nekaj tednih odloča o odobritvi uporabe zdravila v praksi za bolnike z visokim tveganjem za težak potek bolezni.
Kaj pa bolniki z nižjim tveganjem? Tudi na tem področju tečejo klinične raziskave, ki vključujejo tudi cepljene bolnike, poteka pa tudi študija, v kateri ugotavljajo ali lahko Paxlovid prepreči okužbo ljudi, ki so bili v tesnem stiku z bolniki, ki so kazali simptomatsko okužbo. Rezultati obeh testiranj naj bi bili znani še pred koncem leta.
Vir: Pfizer, slika je simbolična
preberite še to
Oddaljeno sobivanje
Mnogi mladi japonski pari raje živijo ločeno in se pogovarjajo preko videokonferenc…
Ujeti galeba
Še ena tistih stvari, pri katerih se sprašujemo, zakaj bi nekdo to počel. Ker lahko?
Velikonočni dvoboj
Pripadniki dveh sosednjih cerkva v Grčiji imajo za velikonočne praznike prav poseben »obred«....
Število, ki je omogočilo, da smo to, kar smo...
Ničla - število, ki je najbolj spremenilo matematiko...
Še je tu!
Znanstveniki so našli čebelo velikanko, za katero so dolgo mislili, da je izumrla.
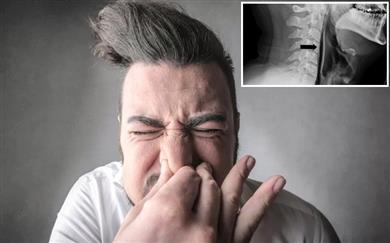
Raje kihnite tako, kot se šika...
Tale Anglež si bo verjetno za celo življenje zapomnil, da si med kihanjem ni dobro zamašiti ust in nosu...
Ali novorojenčki potrebujejo elektronsko pošto?
Prvi odgovor bi seveda bil, da absolutno ne, ko pa malce razmislimo, je ideja pravzaprav genialna. Zakaj?
Sadje, zelenjava in depresija
Študija na dvojčkih razkriva vpliv prehrane na simptome depresije pri starejših od 45 let.
New Work: med obljubo svobode in realnostjo trga
Vizija dela kot prostora smisla in avtonomije se sooča z omejitvami kapitala, tehnologije in človeške n...
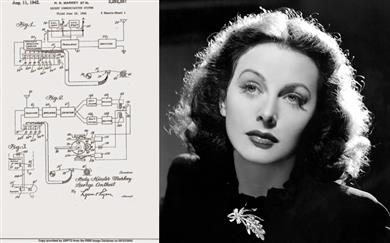
Lepa, predvsem pa pametna
Od nje so pričakovali, da bo z nasmehom očarala javnost in prodajala vojne obveznice. Namesto tega je prispeva...
Telefon vas lahko reši tudi iz žepa…
Brazilski moški, ki sta ga brutalno napadla dva velika psa, trdi, da je ostal živ zaradi eksplozije mob...
Napoleonovo vojsko so zdesetkale bolezni
DNK umrlih vojakov razkriva nove podatke o dogajanju ob katastrofalnem umiku Napoleonove vojske iz Rusije.
Priporočamo še
-
Oddaljeno sobivanje

Mnogi mladi japonski pari raje živijo ločeno in se pogovarjajo preko videokonferenc…
-
Ujeti galeba

Še ena tistih stvari, pri katerih se sprašujemo, zakaj bi nekdo to počel. Ker lahko?
-
Velikonočni dvoboj

Pripadniki dveh sosednjih cerkva v Grčiji imajo za velikonočne praznike prav poseben »obred«... Nič kaj prijazen...
TOP 5 meseca
-
»Vesoljska« prevara

80-letna ženska je plačala za pomoč astronavtu, ki je trdil, da je obtičal v vesolju.
-
Ljudje nismo tako originalni

Le 7 % človekovega genoma je lastnega le človeku. Vse ostalo si delimo z neandertalci in drugimi predniki.
-
Je bilo na Marsu nekoč življenje?

Pred letom dni je NASA sporočila, da je njen rover Curiosity na Marsu odkril dolge molekule organskih spojin. Njihova količina nakazuje na biološki izvor.
-
Napoleonovo vojsko so zdesetkale bolezni

DNK umrlih vojakov razkriva nove podatke o dogajanju ob katastrofalnem umiku Napoleonove vojske iz Rusije.
-
Korenček in ohrovt
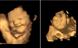
Otroci že v maternici vedo, kaj jim je všeč in kaj ne…